
Рис. 1. Оптическая схема сканирующего проточного цитометра.
Fig. 1. Schematic optical layout of the scanning flow cytometer (SFC).
Координаторы: д-р хим. наук Петров А. К., д-р биол. наук Груздев А. Д.,
д-р биол. наук Рубцов Н. Б.
Исполнители: ИХКГ, ИЦиГ, ИФП, ИБФ, КТИВТ, КТИПМ, ИВМ СО РАН
Разработан и испытан новый сканирующий проточный цитометр (СПЦ) (рис. 1) — поляризационный (СПЦп). Две экспериментальные установки поляризационного сканирующего проточного цитометра используются в исследовательской работе по проекту. Установки расположены в Институте цитологии и генетики СО РАН и в Государственном научном центре вирусологии и биотехнологии “Вектор”. Разработанные установки являются уникальными в мире и представляют четвертое поколение анализаторов одиночных частиц по светорассеянию. На мировом рынке данные анализаторы представлены в основном системами второго поколения, для которых характерным является измерение светорассеяния от одиночных частиц в два фиксированных телесных угла. Созданные установки используются при разработке конструкторской документации на прототип СПЦп.
 |
Рис. 1. Оптическая схема сканирующего проточного цитометра. Fig. 1. Schematic optical layout of the scanning flow cytometer (SFC). |
Созданная оригинальная оптическая система СПЦп позволяет проводить прямую идентификацию несферических частиц (рис. 2). На базе СПЦп разработан метод измерения объема, площади поверхности эритроцита и содержания в нем гемоглобина. Метод использовался при изучении формирования характеристик популяции эритроцитов в процессе их созревания. Создана и апробирована кинетическая модель процесса лизиса эритроцитов при воздействии химических агентов. Данная модель позволяет определять распределение биофизических параметров в популяции эритроцитов, в том числе свойств их мембран.
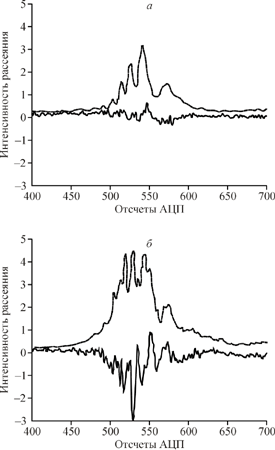 |
Рис. 2. Сигналы светорассеяния для сферической (а) и несферической (б) частиц. Отличие от нуля поляризационного сигнала (сплошная линия) свидетельствует о несферичности частицы. Штриховая линия - стандартный сигнал. Fig. 2. Lightscattering signals from spherical (a) and nonspherical (б) particles. High amplitude of polarization signal (solid line) is typical to nonspherical particles. Stroke line - standard signal. |
Установки СПЦп использовались при создании и апробации кинетической модели взаимодействия молекул лигандов с рецепторами на поверхности клетки. На основе этой модели разработан метод определения силы специфического взаимодействия лиганда с клеточными рецепторами, сертификации клеточной популяции по количественному распределению рецепторов. Создана и апробирована кинетическая модель латексной иммуноагглютинации. Модель использовалась в исследовании влияния агглютинации высших порядков на кинетику иммуноагглютинации.
Разработан метод идентификации стволовых клеток крови по их светорассеянию.
Работоспособность подхода показана на случае редких событий: 0,4 % стволовых клеток в пуповинной крови. Метод является уникальным, потому что для идентификации стволовых клеток не требуются иммуноспецифические флуоресцентные маркеры.
Получил развитие параметрический метод решения обратной задачи светорассеяния для сферических частиц. С использованием преобразования Фурье получено решение, устойчивое к экспериментальным шумам при измерении сигнала светорассеяния на сканирующем проточном цитометре. Получено решение обратной задачи светорассеяния для одиночных сферических частиц с центрально-симметричным ядром, а также для одиночных частиц в форме вытянутого сфероида. Работоспособность решения продемонстрирована при измерении популяции бактерий кишечной палочки на различных стадиях роста.
Список основных публикаций
 Оглавление Оглавление |
Далее 
|