
Сайдалиева М.
Институт кибернетики, Ташкент
Quantitative study of living system mechanisms supposes to take into account the hierarchical interconnection of different levels of their organizations that not methodologically designed and under practical modeling is observed extremely seldom. This first of all concerns to modeling of regulation mechanisms of cellular communities. In spite of great successes of molecular biology, geneticists and cytologies, which are allowing to build sufficiently motivated mathematical models of regulatory mechanisms of cells functioning, modeling of their interconnected activity causes the greater difficulties. In the given work the possible variant of model and software for quantitative study of cellular communities regulatory mechanisms is considered.
Клетки многоклеточного организма в ходе выполнения общих функций
объединены в надклеточные структурно-функциональные образования,
состоящие из характерных зон и составляющие универсальные подсистемы
органов и тканей, выполняющих основную совокупность элементарных
функций живых систем (обновление, специализацию, обмен веществ с
окружающей средой, выполнение специфических функций и старение) - в
функциональные единицы клеточных сообществ (фекс), пространственное и
функциональное образование из которых и составляет органы и ткани
многоклеточного организма [8,9,10]. Принцип биологического
эпиморфизма Н.
Рашевски [6] является теоретической основой фекс, а принципы блочной
организации [16] могут быть использованы для построения клеточных систем
органов и тканей на основе взаимосвязанных фекс.
Определение: связное множество (по пространству или (и) по времени) клеток называется фекс, если
в нем имеются делящиеся ![]() , растущие
, растущие ![]() , дифференцирующиеся
, дифференцирующиеся
![]() ,
выполняющие специфические функции
,
выполняющие специфические функции
![]() и стареющие
и стареющие
![]() клеточные
группы, функционирующие взаимосвязанно, как единое целое (
клеточные
группы, функционирующие взаимосвязанно, как единое целое (![]() - количество
специфических функций фекс) [9].
- количество
специфических функций фекс) [9].
В данном подходе органы и ткани рассматриваются как системы, в которых элементарной составляющей является фекс. Применяемые методы моделирования функциональных единиц зависят от степени их разработанности, от сложившихся традиций при исследовании данного класса явлений и от конкретных особенностей рассматриваемой функциональной единицы. Нами разработаны два подхода количественного исследования регуляторных механизмов клеточных сообществ на основе фекс: исследование наиболее общих закономерностей динамики численности клеточных групп в сообществе и имитационное моделирование клеточных сообществ с учетом механизмов регуляции внутриклеточных процессов [8,9,10].
Предполагая для простоты наличие двух специфических функций
![]() и
и ![]() ,
рассмотрим один из возможных вариантов исследования механизмов
регуляции численности клеток в отдельных зонах
,
рассмотрим один из возможных вариантов исследования механизмов
регуляции численности клеток в отдельных зонах
![]() фекс с
помощью функционально-дифференциальных уравнений. Пусть
фекс с
помощью функционально-дифференциальных уравнений. Пусть
![]() - величины, характеризующие численности делящихся, растущих,
дифференцирующихся, выполняющих специфические функции и стареющих
клеток;
- величины, характеризующие численности делящихся, растущих,
дифференцирующихся, выполняющих специфические функции и стареющих
клеток; ![]() - текущее время. Можно принять, что закономерность изменения
численности делящихся клеток зависит от численностей клеток, находящихся в
- текущее время. Можно принять, что закономерность изменения
численности делящихся клеток зависит от численностей клеток, находящихся в
![]() , и в
, и в ![]() зонах фекс
[3,6,16]. С учетом временных взаимоотношений в
фекс и миграции клеток из пролиферативной зоны, для
зонах фекс
[3,6,16]. С учетом временных взаимоотношений в
фекс и миграции клеток из пролиферативной зоны, для ![]() можно написать
следующее уравнение
можно написать
следующее уравнение
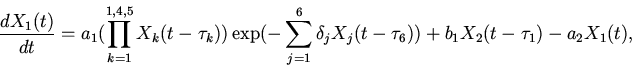 |
(1) |
| (2) |
Имея ввиду, что
- в зонах роста ![]() , дифференцировки
, дифференцировки ![]() , выполнения специфических
функций
, выполнения специфических
функций
![]() и старения
и старения ![]() ''рождения'' клеток не происходит;
''рождения'' клеток не происходит;
- во временном аспекте в этих зонах изменение численностей клеток
происходит быстрее, чем в зоне деления ![]() и обычно транслирует их,
мы можем для качественного исследования допустить равновесный характер
количественных изменений клеток в рассматриваемых зонах. Тогда
конкретные значения численностей клеток в рассматриваемых зонах могут
быть вычислены по значению численности делящихся клеток и система
уравнений (1), (2) может быть упрощена. Здесь, при определенных условиях,
накладываемых на значения параметров рассматриваемых уравнений, можно
воспользоваться результатами известной теоремы А.Н. Тихонова
[17]
о редукции систем дифференциальных уравнений и биофизических способов
сокращения числа уравнений математических моделей биологических
процессов [7]. Тогда характерное поведение фекс около положений
равновесия может быть исследовано на основе следующего
функционально-дифференциального уравнения
и обычно транслирует их,
мы можем для качественного исследования допустить равновесный характер
количественных изменений клеток в рассматриваемых зонах. Тогда
конкретные значения численностей клеток в рассматриваемых зонах могут
быть вычислены по значению численности делящихся клеток и система
уравнений (1), (2) может быть упрощена. Здесь, при определенных условиях,
накладываемых на значения параметров рассматриваемых уравнений, можно
воспользоваться результатами известной теоремы А.Н. Тихонова
[17]
о редукции систем дифференциальных уравнений и биофизических способов
сокращения числа уравнений математических моделей биологических
процессов [7]. Тогда характерное поведение фекс около положений
равновесия может быть исследовано на основе следующего
функционально-дифференциального уравнения
| (3) |
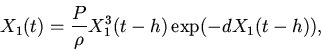 |
(4) |
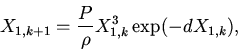 |
(5) |
Анализ характерных поведений решений (3)-(5) c использованием методов
качественного исследования дифференциально-разностных уравнений
[2,11]
показывает наличие тривиального положения равновесия и возможность
существования нетривиальных положений равновесия ![]() ,
, ![]()
![]() ,
неустойчивость
,
неустойчивость ![]() и разнообразное поведение решений около
и разнообразное поведение решений около ![]() : устойчивое
стационарное состояние, предельные циклы типа Пуанкаре и нерегулярные
колебания; существование ( при рассмотрении (5)), эффекта срыва
колебательных решений к тривиальному положению равновесия (эффект
''черная дыра'') [11,12]. Закономерности возникновения и развития
динамического хаоса у (5) были анализированы путем вычисления значений
Ляпуновской величины и построения диаграмм Кенингса-Ламерея
[6,11,12].
: устойчивое
стационарное состояние, предельные циклы типа Пуанкаре и нерегулярные
колебания; существование ( при рассмотрении (5)), эффекта срыва
колебательных решений к тривиальному положению равновесия (эффект
''черная дыра'') [11,12]. Закономерности возникновения и развития
динамического хаоса у (5) были анализированы путем вычисления значений
Ляпуновской величины и построения диаграмм Кенингса-Ламерея
[6,11,12].
Разработанное на основе данного подхода программное обеспечение
количественного исследования закономерностей динамики численности клеток
в клеточном сообществе ![]() позволяет проводить вычислительные
эксперименты с конкретными клеточными сообществами органов и тканей
растительных и животных организмов [14]. Перейдем к рассмотрении
второго подхода количественного исследования регуляторных механизмов
клеточных сообществ.
позволяет проводить вычислительные
эксперименты с конкретными клеточными сообществами органов и тканей
растительных и животных организмов [14]. Перейдем к рассмотрении
второго подхода количественного исследования регуляторных механизмов
клеточных сообществ.
На основе введенной фекс нами разработаны
модельное и программное обеспечения ''Имитационная клеточная модель
развития (ИКМР)'' для моделирования регуляторных механизмов клеточных
сообществ растительных и животных организмов. При построении
регуляторных механизмов моделей конкретных клеточных функций (деления,
роста, дифференцировки, выполнения специфических функций и старения)
на основе регуляционной схемы Жакоба-Моно использованы подходы Б.
Гудвина, Б. Сендова, Р. Цанева и Б.Н. Хидирова [8,9,10].
Характерные особенности построения уравнений регуляторных механизмов
клеточных функций видны из следующих уравнений модели механизмов
регуляции клеточного деления (митоза) [8,13]
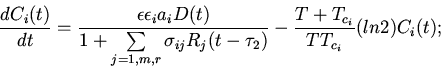
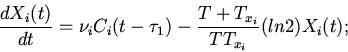
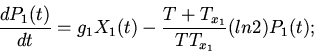
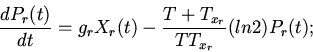
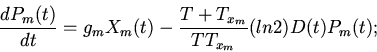
| (6) |
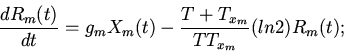
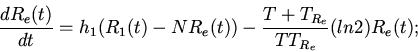
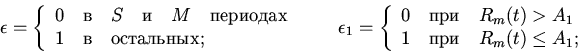
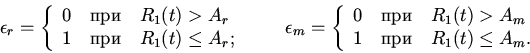
ИКМР позволяет проводить вычислительные эксперименты с учетом динамики пространственной архитектоники клеточного сообщества и закономерностей регуляции внутриклеточных процессов. Использование ИКМР для анализа механизмов взаимодействия плодовых клеток хлопчатника и гриба, вызывающего вилт, перехода растений к цветению и приспособительных реакций пищеварительной системы организма на внешние воздействия показало эффективность моделирования регуляторных механизмов клеточных сообществ растительных и животных организмов на основе фекс [6,10,13,16].
Апробация модельного и программного обеспечения по имитационному моделированию регуляторных механизмов клеточных сообществ была проведена в ходе исследования механизмов структурно-функциональной организации всасывания питательных веществ в пищеварительной системе организма (совместно с сотрудниками кафедры гистологии и эмбриологии ТашГосМИ-1, зав. академик АН РУз К.А. Зуфаров). В рассматриваемом процессе главная роль принадлежит системе ''крипта-ворсинка'' - основной функциональной единице пищеварительной системы организма [3,4].
При построении модели клеточного сообщества ''крипта-ворсинка'' были разработаны конкретные уравнения пролиферативных, дифференцирующихся, бокаловидных, каемчатых клеток и программное обеспечение для проведения вычислительных экспериментов на модельном клеточном поле размером 10х6 клеток. На этом поле имитировалась клеточная структура, а параметры состояния внутренней (кровеносная) и внешней (просвет кишечника) среды представлялись соответствующими матрицами. При моделировании процесса всасывания имитировались активности гликокаликсового слоя, гидролитически-транспортных и метаболических ферментов. Перемещение клеток моделировалось на основе давления, создаваемого пролиферативным пулом, и скоростью вылущивания стареющих клеток в просвет кишечника. В качестве конкретного объекта была взята крипта-ворсинка тощей кишки [4].
В ходе вычислительных экспериментов были рассмотрены условия внешних и внутренних сред: суточное изменение параметров поступающих веществ в просвет кишечника, различные концентрации углеводов, аминокислот и жиров в кровеносной системе, нагружение организма жиром и т.д.. Было выявлено увеличение численности делящихся клеток в ночные часы, что приводило к накоплению резервных клеток и значительному повышению скорости обновления клеток в утренние часы.
Вычислительные эксперименты с нагружением организма жиром показали последовательное усиление активности всасывающих клеток и усиление миграции клеток за счет уменьшения времен дифференцировки и нахождения клеток в зоне роста, за счет вовлечения растущих клеток в деление и увеличения доли делящихся клеток в пролиферативном пуле и, наконец, за счет уменьшения времени деления клеток пролиферативного пула по мере увеличения концентрации жира в просвете кишечника. Наблюдался колебательный характер численности клеток и высоты ворсинки в широких пределах (до 25-30 процентов) что является, по-видимому, естественным режимом функционирования системы ''крипта-ворсинка''. Проведенные исследования показали большую чувствительность модели к внешним воздействиям [4].
На основе разработанного модельного обеспечения количественных исследований регуляторики клеточных сообществ, совместно с сотрудниками кафедры ХПС ТашГУ, были анализированы закономерности взаимодействия хлопчатника и гриба V.dahliea, вызывающего вилт [5]. Исследовались механизмы взаимоотношения клеток несовершенных грибов и высших растений в норме и при некоторых экстремальных воздействиях, приводящих к нарушению динамического равновесия комплекса взаимосвязанных обменных реакций. Как показали результаты вычислительных экспериментов, существует симбиотический режим функционирования хлопчатника и гриба, нарушение которого приводит к подавлению роста и развития хлопчатника грибом. Сохранение симбиотического режима предотвращает заболеваемость растений вилтом и создает благоприятные, для сосуществующих видов, условия жизнедеятельности.
В ходе вычислительных экспериментов были исследованы возможные изменения в системе регуляции симбиотического комплекса ''высшее растение и паразитарный гриб'' при стрессовых условиях. Общие характеристики поведения модели взаимосвязанной деятельности клеток хлопчатника и гриба во всех случаях экстремального воздействия были приблизительно одинаковыми. После короткого латентного периода в плодовых клетках хлопчатника происходило торможение образования белков-ферментов, далее - торможение обмена веществ и в конечном итоге наступало подавление активности плодовых клеток хлопчатника [5].
Разработанные подходы моделирования регуляторных механизмов клеточных сообществ были успешно применены при анализе клеточных механизмов роста и развития хлопчатника [15] и при выявлении закономерностей динамики численности возрастной популяции [1,18].
Формулирование понятия функциональной единицы клеточных сообществ
(фекс), разработка математической и компьютерной моделей динамики
численности однородных клеточных групп открывают, по нашему мнению,
большие возможности для модельных исследований регуляторных механизмов
клеточных систем животных и растительных организмов в норме и при
аномалиях. Общий качественный и количественный анализ уравнений фекс
позволяет выявлять закономерности динамики численности клеток в
последовательных зонах фекс (деления, роста, дифференцировки, выполнения
специфических функций и старения), а имитационные модельные исследования
позволяют определять количественные закономерности существования
конкретных клеточных структур с учетом пространственной архитектоники
клеток и регуляции внутриклеточных процессов.
 Ваши комментарии
Ваши комментарии
|
![[SBRAS]](/gif/s_sigma.gif)
[Головная страница] [Конференции] [СО РАН] |
© 2001, Сибирское отделение Российской академии наук, Новосибирск
© 2001, Объединенный институт информатики СО РАН, Новосибирск
© 2001, Институт вычислительных технологий СО РАН, Новосибирск
© 2001, Институт систем информатики СО РАН, Новосибирск
© 2001, Институт математики СО РАН, Новосибирск
© 2001, Институт цитологии и генетики СО РАН, Новосибирск
© 2001, Институт вычислительной математики и математической геофизики СО РАН, Новосибирск
© 2001, Новосибирский государственный университет
Дата последней модификации Wednesday, 05-Sep-2001 21:43:21 NOVST