![$
\frac{\displaystyle dK}{\displaystyle dt}
= \beta K -
g(t)\Bigl(l_1g_1+l_2g...
...t \frac{\displaystyle
K}{\displaystyle V} \hfill{\displaystyle (1)}\\ [0.cm]
$](img3.gif)
![$
\frac{\displaystyle dM_A}{\displaystyle dt}
=\gamma K +
\alpha_M (M_A^*-M_A...
...\frac{\displaystyle
M_A}{\displaystyle V} \hfill{\displaystyle (2)}\\ [0.cm]
$](img4.gif)
![$
\frac{\displaystyle dN_A}{\displaystyle dt}
=\chi KM_A + \alpha_N (N_A^*-N_A...
... \frac{\displaystyle
N_A}{\displaystyle V}\hfill{\displaystyle (3)}\\ [0.cm]
$](img5.gif)
![$
\frac{\displaystyle dV}{\displaystyle dt} = \delta (V^{\mathit{max}}-V)K +
\alpha_V(V^*-V)\hfill{\displaystyle (4)}\\ [0.cm]
$](img6.gif)
![$
\frac{\displaystyle dM_K}{\displaystyle dt} = (M_K^{\mathit{max}}-M_K)\gamma_{MK}K -
\alpha_{MK}M_K\hfill{\displaystyle (5)}\\ [0.cm]
$](img7.gif)
![$
\frac{\displaystyle dH_B}{\displaystyle dt}
=b_H\Bigl[\rho_HM_K(t-\tau_H)H_B...
..._B\Bigr] - b_PM_KH_BB
+\alpha_H(H^*_B-H_B)\hfill{\displaystyle (6)}\\ [0.cm]
$](img8.gif)
![$
\frac{\displaystyle dB}{\displaystyle dt}
=b^B_P\Bigl[\rho_BM_K(t-\tau_B)H_B...
...t-\tau_B) - M_KH_BB\Bigr]
+\alpha_B(B^*-B)\hfill{\displaystyle (7)}\\ [0.cm]
$](img9.gif)
![$
\frac{\displaystyle dP}{\displaystyle dt}
=b^P_P\rho_PM_K(t-\tau_P)H_B(t-\tau_P)B(t-\tau_P)+
\alpha_P(P^*-P)\hfill{\displaystyle (8)}\\ [0.cm]
$](img10.gif)
![$
\frac{\displaystyle dF}{\displaystyle dt}
=\rho_FP+\alpha_F(F^*-F)\hfill{\displaystyle (9)}\\ [0.cm]
$](img11.gif)
![$
\frac{\displaystyle dm}{\displaystyle dt}=
\sigma K + \alpha_m(m^*-m) - \fra...
... \frac{\displaystyle m}{\displaystyle
V}\hfill{\displaystyle (10)}\\ [0.1cm]
$](img12.gif)

Руднев С.Г., Романюха А.А.
Институт вычислительной математики РАН, Новосибирск
The mathematical model of lung immune defense is constructed. Model-based approach to estimate the energy cost of disease and of health maintenance is suggested. The problem of parameters identification is formulated using the variational principle of minimal energy dissipation. The approach is applied to the interpretation of mechanisms of development and treatment methods of chronic lung bacterial infections.
Введение. Одним из важных направлений применения математических методов в иммунологии и медицине является математическое моделирование инфекционных заболеваний. Это направление возникло около 30 лет назад и развивается усилиями различных групп исследователей в России, США, Великобритании, Италии, Израиле и др. странах.
Развитие клинической и экспериментальной иммунологии постепенно привело к пониманию ведущей роли иммунных защитных механизмов в патогенезе инфекционных болезней, а вместе с совершенствованием вычислительной техники - к созданию соответствующих математических моделей (см., напр.: Молчанов, 1971; Марчук, 1975, 1991; Ханин, Элькин, 1976; Марчук, Петров, 1981, 1983; Marchuk et al., 1991а,б; Bocharov, Romanyukha, 1994; Nowak, May, 2000). Часть моделей из упомянутых работ имеет достаточно простой и удобный для аналитического исследования вид, что дает возможность изучать наиболее общие закономерности динамики иммунной защиты организма; другой задачей, для решения которой используются модели, является анализ конкретных механизмов иммунитета, что неизбежно приводит к высокой размерности векторов зависимых переменных и параметров таких моделей. Традиционным методом исследования нелинейных многопараметрических задач является имитационное моделирование. Одной из наиболее часто решаемых в рамках этого подхода задач является восстановление параметров по данным наблюдений (стандартная идентификация параметров). Данные в рассматриваемой области знаний как правило характеризуются неполнотой и противоречивостью, что затрудняет анализ моделей и интерпретацию получаемых результатов. Неполнота данных создает проблему обоснованности (неединственности) оценок параметров моделей. Особенностью существующих математических моделей в иммунологии является то, что они предназначены для исследования переходных процессов в иммунной системе (например динамики иммунного ответа в случае острых инфекций). Это не позволяет проводить теоретическое исследование таких важных задач современной иммунологии, как определение нормы иммунной реакции и иммунодефицитов, а также изучение механизмов развития и способов контроля хронических инфекций и аллергий. Указанные причины привели к необходимости поиска, обоснования и применения более общих закономерностей функционирования иммунной защиты организма, основанных на качественно иных принципах по сравнению с использованными ранее в этой области.
Предлагаемый подход основан на применении теории естественного отбора к анализу функционирования иммунной системы. Важно отметить, что инфекционные заболевания представляют собой один из ведущих факторов отбора организмов, поскольку, например, ответственны более чем за половину случаев преждевременной смерти людей и, кроме того, являются главной причиной временной потери трудоспособности (WHO Report on Infectious Diseases, 1999). При этом основная часть инфекций локализована в легких (которые образно называют "воротами инфекции'').
Для исследования закономерностей противоинфекционной защиты легких применен вариационный принцип (энергетический критерий эффективности), основанный на предположении о том, что среди допустимых вариантов иммунной защиты организма реализуются те, которые минимизируют затраты энергии на взаимодействие с инфекционными патогенами (Романюха, 1996). На основе математической модели острой бактериальной пневмонии построена модель, описывающая динамику противоинфекционной защиты легких на длительных отрезках времени, включающих как периоды инфекций, так и здоровья. Критерий эффективности применен для уточнения значений параметров модели противоинфекционной защиты. Результаты использованы для интерпретации механизмов развития и методов лечения хронических бактериальных инфекций легких.
Математическая модель противоинфекционной защиты легких. Система уравнений
математической модели пневмонии, описывающих динамику локальной воспалительной реакции
и гуморального иммунного ответа, имеет следующий вид:
![$
\frac{\displaystyle dK}{\displaystyle dt}
= \beta K -
g(t)\Bigl(l_1g_1+l_2g...
...t \frac{\displaystyle
K}{\displaystyle V} \hfill{\displaystyle (1)}\\ [0.cm]
$](img3.gif)
![$
\frac{\displaystyle dM_A}{\displaystyle dt}
=\gamma K +
\alpha_M (M_A^*-M_A...
...\frac{\displaystyle
M_A}{\displaystyle V} \hfill{\displaystyle (2)}\\ [0.cm]
$](img4.gif)
![$
\frac{\displaystyle dN_A}{\displaystyle dt}
=\chi KM_A + \alpha_N (N_A^*-N_A...
... \frac{\displaystyle
N_A}{\displaystyle V}\hfill{\displaystyle (3)}\\ [0.cm]
$](img5.gif)
![$
\frac{\displaystyle dV}{\displaystyle dt} = \delta (V^{\mathit{max}}-V)K +
\alpha_V(V^*-V)\hfill{\displaystyle (4)}\\ [0.cm]
$](img6.gif)
![$
\frac{\displaystyle dM_K}{\displaystyle dt} = (M_K^{\mathit{max}}-M_K)\gamma_{MK}K -
\alpha_{MK}M_K\hfill{\displaystyle (5)}\\ [0.cm]
$](img7.gif)
![$
\frac{\displaystyle dH_B}{\displaystyle dt}
=b_H\Bigl[\rho_HM_K(t-\tau_H)H_B...
..._B\Bigr] - b_PM_KH_BB
+\alpha_H(H^*_B-H_B)\hfill{\displaystyle (6)}\\ [0.cm]
$](img8.gif)
![$
\frac{\displaystyle dB}{\displaystyle dt}
=b^B_P\Bigl[\rho_BM_K(t-\tau_B)H_B...
...t-\tau_B) - M_KH_BB\Bigr]
+\alpha_B(B^*-B)\hfill{\displaystyle (7)}\\ [0.cm]
$](img9.gif)
![$
\frac{\displaystyle dP}{\displaystyle dt}
=b^P_P\rho_PM_K(t-\tau_P)H_B(t-\tau_P)B(t-\tau_P)+
\alpha_P(P^*-P)\hfill{\displaystyle (8)}\\ [0.cm]
$](img10.gif)
![$
\frac{\displaystyle dF}{\displaystyle dt}
=\rho_FP+\alpha_F(F^*-F)\hfill{\displaystyle (9)}\\ [0.cm]
$](img11.gif)
![$
\frac{\displaystyle dm}{\displaystyle dt}=
\sigma K + \alpha_m(m^*-m) - \fra...
... \frac{\displaystyle m}{\displaystyle
V}\hfill{\displaystyle (10)}\\ [0.1cm]
$](img12.gif)
Подробное описание построения и анализа системы уравнений модели можно найти в работе
(Романюха, Руднев, 2001). Основными особенностями этой модели является следующее: 1) в
модели описано явление устойчивости состояния здоровья к заражению небольшими дозами
бактерий, которая обеспечивается благодаря функционированию альвеолярных макрофагов
(![]() ) и других защитных систем; 2) к развитию пневмонии приводят лишь значительные
нарушения функции альвеолярных макрофагов. Эти нарушения описаны в модели при помощи
функции
) и других защитных систем; 2) к развитию пневмонии приводят лишь значительные
нарушения функции альвеолярных макрофагов. Эти нарушения описаны в модели при помощи
функции ![]() (см. (1) и (2)). Известно, что основной причиной развития бактериальной
пневмонии являются острые респираторные вирусные инфекции. На основании
экспериментальных данных, характеризующих влияние вирусной инфекции на интенсивность
фагоцитоза бактерий альвеолярными макрофагами, функцию
(см. (1) и (2)). Известно, что основной причиной развития бактериальной
пневмонии являются острые респираторные вирусные инфекции. На основании
экспериментальных данных, характеризующих влияние вирусной инфекции на интенсивность
фагоцитоза бактерий альвеолярными макрофагами, функцию ![]() можно представить в
следующем виде:
можно представить в
следующем виде:
На основании теорем, доказанных в (Сидоров, 1989), легко получить, что при условии
достаточной гладкости функции ![]() , а также положительности параметров и
неотрицательности начальных условий, решение задачи (1)-(11) существует,
единственно, неотрицательно и ограничено на любом конечном интервале времени
, а также положительности параметров и
неотрицательности начальных условий, решение задачи (1)-(11) существует,
единственно, неотрицательно и ограничено на любом конечном интервале времени
![]() , где
, где ![]() .
.
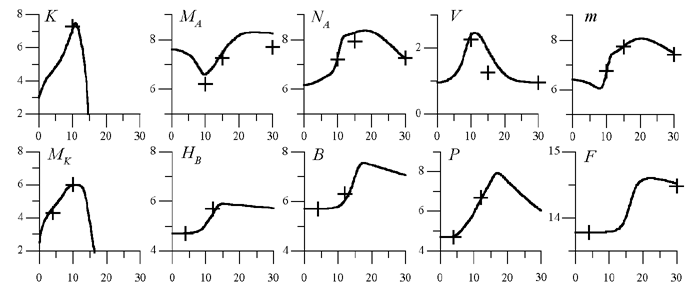
Численное решение системы уравнений модели, соответствующее уточненным в результате процедуры идентификации значениям параметров (табл. 1), показано на рис. 1.
 |
|
N п/п |
Параметр | Размерность | Физический смысл | Значение |
| 1 | сут |
Константа скорости размножения бактерий | 2,7 | |
| 2 |
|
Константа скорости фагоцитоза бактерий альвеолярными макрофагами (АМ) на поверхности альвеол | 1,36 |
|
| 3 |
|
Константа скорости фагоцитоза бактерий АМ в объеме жидкости | 1,36 |
|
| 4 |
|
Константа скорости фагоцитоза бактерий нейтрофилами на поверхности альвеол | 2,7 |
|
| 5 |
|
Константа скорости фагоцитоза бактерий нейтрофилами в объеме | 2,7 |
|
| 6 |
|
Константа скорости хемотаксиса нейтрофилов | 7,57 |
|
| 7 |
|
Константа скорости нарастания альвеолярного отека | 3,22 |
|
| 8 | безразм. | Максимальная кратность снижения скорости фагоцитоза бактерий АМ в ходе вирусной инфекции | 5 | |
| 9 | безразм. | Величина, обратная максимальному количеству бактерий, поглощенных одним АМ | 10 |
|
| 10 | безразм. | Величина, обратная максимальному количеству бактерий, поглощенных одним нейтрофилом | 2 |
|
| 11 | сут |
Константа скорости восстановления способности АМ к фагоцитозу бактерий после вирусной инфекции | 0,1 | |
| 12 | сут |
Константа скорости хемотаксиса моноцитов | 1,96 |
|
| 13 | сут |
Величина, обратная среднему времени жизни АМ | 3 |
|
| 14 | сут |
Величина, обратная среднему времени жизни нейтрофила в альвеолах | 0,32 | |
| 15 | сут |
Константа скорости удаления жидкости отека из альвеол | 0,48 | |
| 16 | сут |
Константа скорости удаления разрушенных клеток из участка повреждения | 0,2 | |
| 17 | сут |
Константа скорости разрушения клеток в органе-мишени | 0,71 | |
| 18 |
|
Концентрация АМ в объеме альвеолярного сурфактанта (норма) | 4 |
|
| 19 |
|
Концентрация нейтрофилов в объеме альвеолярного сурфактанта (норма) | 1,5 |
|
| 20 |
|
Концентрация разрушенных клеток в объеме сурфактанта (норма) | 2,5 |
|
| 21 | мл | Объем альвеолярного сурфактанта в норме | 9,0 | |
| 22 |
|
мл | Максимальный объем жидкости альвеолярного отека | 3,0 |
| 23 |
|
Константа скорости активации макрофагов | 3,7 |
|
| 24 |
|
Константа скорости стимуляции клеток |
7,9 |
|
| 25 |
|
Константа скорости расхода клеток |
1,7 |
|
| 26 |
|
Константа скорости стимуляции В-лимфоцитов при описании числа В-лимфоцитов | 2 |
|
| 27 |
|
Константа скорости стимуляции В-лимфоцитов при описании числа плазматических клеток | 4 |
|
| 28 | сут |
Константа скорости потери макрофагами состояния активации | 3,0 | |
| 29 | сут |
Константа скорости естественной гибели клеток |
3 |
|
| 30 | сут |
Константа скорости естественной гибели В-лимфоцитов | 10 |
|
| 31 | сут |
Константа скорости естественной гибели плазматических клеток | 0,4 | |
| 32 | сут |
Константа скорости увеличения концентрации специфических антител в крови в результате их синтеза плазматическими клетками | 10 |
|
| 33 | сут |
Константа скорости естественной гибели специфических антител | 4,3 |
|
| 34 | безразм. | Число потомков клетки |
2 | |
| 35 | безразм. | Число потомков клетки |
16 | |
| 36 | безразм. | Число плазматических клеток в результате одного цикла делений В-лимфоцита | 3 | |
| 37 |
|
|
Максимальная концентрация активированных макрофагов в ЛУ | 10 |
| 38 |
|
Нормальная концентрация клеток |
5 |
|
| 39 |
|
Нормальная концентрация специфических В-лимфоцитов в ЛУ | 5 |
|
| 40 |
|
Нормальная концентрация плазматических клеток, синтезирующих антитела к S.aureus в ЛУ | 5 |
|
| 41 |
|
Нормальная концентрация специфических антител в крови | 6 |
|
| 42 | сут | Продолжительность цикла делений клеток |
0,4 | |
| 43 | сут | Продолжительность цикла делений клеток |
3 | |
| 44 | сут | Продолжительность цикла делений и дифференцировки
клеток |
3 |
Учитывая перечисленные ранее особенности построенной математической модели, ее можно рассматривать не только как модель отдельного заболевания, но и как модель процесса противобактериальной защиты легких в целом как во время инфекции, так и в периоды здоровья, т.е. как модель противоинфекционной защиты легких.
Анализ эпидемических, клинических и лабораторных данных показывает, что в популяции людей реализуются определенные стратегии взаимоотношений с бактериями. В норме в организме поддерживается достаточно высокий уровень как неспецифической (фагоциты, комплемент и др.), так и специфической (антитела, лимфоциты) защиты. Однако эта защита не имеет абсолютного характера, и с определенной частотой в популяции наблюдаются инфекции различной степени тяжести, хотя очевидно, что физиологически допустимые сдвиги определенных параметров защитных систем могут понизить и частоту, и тяжесть заболеваний. Почему, тем не менее, поддерживаются такие режимы функционирования защитных систем, которые допускают определенный уровень заболеваемости? В биологии этот вопрос рассматривается как выбор организмом стратегии, варьирующей от состояния резистентности (защищенности от инфекции), до болезни, как компромисса с патогеном (Gemmill, Read, 1998). Можно предположить, что высокоэффективная защита, удлиняющая периоды здоровья, может оказаться слишком обременительной для организма, как и слишком частые заболевания. Для рассмотрения этой проблемы в рамках построенной модели необходимо сравнить между собой потери организма на защиту в периоды здоровья и потери на болезнь. Одним из возможных подходов является сравнение расходов энергии на соответствующие процессы. При построении количественных оценок энергетической цены противоинфекционной защиты важное значение имеет определение энергетической цены болезни, и в том числе различных процессов иммунной защиты легких в ходе болезни.
Энергетическая цена пневмонии.
Рассмотрим структуру расходов энергии в организме, вызванных бактериальной
пневмонией. Пусть ![]() - энергетическая цена пневмонии. Эта величина включает
энергию, используемую на синтез и жизнедеятельность (метаболизм) инфекционных
патогенов в легких (обозначим ее
- энергетическая цена пневмонии. Эта величина включает
энергию, используемую на синтез и жизнедеятельность (метаболизм) инфекционных
патогенов в легких (обозначим ее ![]() ), расходы энергии на образование новых
и поддержание функционирования уже имеющихся клеток иммунной системы,
осуществляющих иммунную защиту легких (
), расходы энергии на образование новых
и поддержание функционирования уже имеющихся клеток иммунной системы,
осуществляющих иммунную защиту легких (![]() ), расходы на регенерацию
поврежденных клеток органа-мишени (
), расходы на регенерацию
поврежденных клеток органа-мишени (![]() ) и уменьшение отека (
) и уменьшение отека (![]() ), а
также потери энергии в результате общего нарушения баланса притоков и
расходов энергии и веществ в организме в ходе инфекционного патологического
процесса (
), а
также потери энергии в результате общего нарушения баланса притоков и
расходов энергии и веществ в организме в ходе инфекционного патологического
процесса (![]() ). Имеем:
). Имеем:
Известно, что основная часть энергии, потребляемой бактериями в фазе
экспоненциального роста, затрачивается на образование новых бактериальных
клеток. Пусть ![]() - длительность инфекции. Тогда выражение для величины
- длительность инфекции. Тогда выражение для величины ![]() запишется в виде
запишется в виде
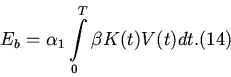
В соответствии с этой классификацией рассмотрим следующие компоненты
энергетической цены иммунной защиты легких:
![]() - расход
энергии на образование неспецифических компонент иммунной защиты легких;
- расход
энергии на образование неспецифических компонент иммунной защиты легких;
![]() - расход энергии на образование специфических
компонент иммунной защиты легких;
- расход энергии на образование специфических
компонент иммунной защиты легких;
![]() - расход энергии
на функционирование неспецифических компонент иммунной защиты легких;
- расход энергии
на функционирование неспецифических компонент иммунной защиты легких;
![]() - расход энергии на функционирование специфических
компонент иммунной защиты легких;
- расход энергии на функционирование специфических
компонент иммунной защиты легких;
![]() - расход энергии
на постоянную неспецифическую иммунную защиту легких;
- расход энергии
на постоянную неспецифическую иммунную защиту легких;
![]() - расход энергии на постоянную специфическую
иммунную защиту легких;
- расход энергии на постоянную специфическую
иммунную защиту легких;
![]() - расход энергии на
индуцируемую неспецифическую иммунную защиту легких;
- расход энергии на
индуцируемую неспецифическую иммунную защиту легких;
![]() - расход энергии на индуцируемую специфическую
иммунную защиту легких. Имеем:
- расход энергии на индуцируемую специфическую
иммунную защиту легких. Имеем:
Выражения для величин, входящих в правую часть (18), могут быть построены на основе,
например, системы уравнений математической модели пневмонии (1)-(10). Так, величина
![]() может быть вычислена следующим образом:
может быть вычислена следующим образом:
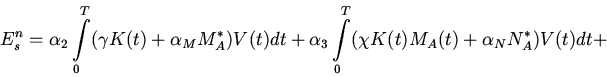
и представляет собой сумму расходов энергии на образование фагоцитов, поступающих в
поврежденные в ходе инфекции (1-е и 2-е слагаемые в правой части (19)) и нормальные
сегменты легких (3-е и 4-е слагаемые). ![]() есть общий объем альвеолярного
сурфактанта в легких в норме. Аналогичным образом вычисляются остальные компоненты
энергетической цены иммунной защиты легких. По аналогии с использованными обозначениями
составляющих величины
есть общий объем альвеолярного
сурфактанта в легких в норме. Аналогичным образом вычисляются остальные компоненты
энергетической цены иммунной защиты легких. По аналогии с использованными обозначениями
составляющих величины ![]() рассмотрим максимальные мощности рассмотренных компонент
расхода энергии и обозначим их как
рассмотрим максимальные мощности рассмотренных компонент
расхода энергии и обозначим их как ![]() с соответствующими индексами.
с соответствующими индексами.
В табл. 2 представлены оценки значений величин удельных расходов энергии в ходе болезни, полученные на основании разнообразных количественных данных об энергетике рассматриваемых биологических процессов (Spector, 1956; Гунзалус, Шустер, 1963; Lehninger, 1971; Иванов, 1990, и др.), а в табл.3 - значения основных величин, характеризующих энергетическую цену процессов противоинфекционной защиты легких при пневмонии.
|
Пара- метр |
Размерность | Оценка | Значение |
Пара- метр |
Размерность | Оценка | Значение |
|
|
Дж/кл | 8 |
3 |
||||
|
|
То же | 9 |
3,6 |
Дж/(сут |
4 |
1,7 |
|
|
|
То же | 2 |
8,1 |
То же | 10 |
3,8 |
|
|
|
Дж/мл | 1-6 | 2,9 | ||||
|
|
Дж/кл | 2 |
9 |
|
То же | 10 |
4,3 |
|
|
То же | 7 |
2,7 |
|
То же | 3 |
1,3 |
|
|
То же | 7 |
2,7 |
|
То же | 3 |
1,3 |
|
|
То же | 2 |
9 |
|
То же | 10 |
4,3 |
|
|
Дж/мол. | 5 |
9 |
||||
|
|
Дж/кл | 9 |
3,6 |
|
То же | 2 |
6,3 |
| Величина | Значение, [Дж] |
Величина | Значение, [Дж] |
Величина | Значение, [Вт] |
Величина | Значение, [Вт] |
|
|
1,2 | 2,2 |
|
8,3 |
|
4,5 |
|
|
|
3,8 |
9,4 |
|
6,4 |
|
65 | |
|
|
1,3 |
6,2 |
|
3,6 |
|
7,2 |
|
|
|
1,7 |
3,9 |
|
2,1 |
|
4,6 |
|
|
|
7,9 |
1,8 |
|
0,27 |
|
0,21 | |
|
|
2,3 |
3,0 |
|
3,1 |
|
6,0 |
На основе анализа табл. 3 важно отметить следующее: 1) основная часть (до 90%)
энергетической цены пневмонии средней тяжести приходится на потери энергии вследствие
снижения приспособленности, и составляет согласно полученной оценке около половины
энергии среднесуточного нормального метаболизма; 2) в структуре иммунной и
фагоцитарной защиты легких наибольшее количество энергии затрачивается на поддержание
жизнедеятельности фагоцитов, и составляет примерно 8% от величины ![]() (суммарной
энергетической цены пневмонии); наиболее высокие мгновенные скорости расхода энергии на
иммунную и фагоцитарную защиту связаны с поддержанием жизнедеятельности фагоцитирующих
клеток в период выраженной воспалительной реакции; 3) расходы энергии на постоянную (в
отсутствие инфекции) фагоцитарную и иммунную защиту легких сопоставимы по величине;
4) наименьшие расходы энергии связаны со специфическим
противобактериальным иммунным ответом, регенерацией легких и уменьшением отека, а также
метаболизмом бактерий.
(суммарной
энергетической цены пневмонии); наиболее высокие мгновенные скорости расхода энергии на
иммунную и фагоцитарную защиту связаны с поддержанием жизнедеятельности фагоцитирующих
клеток в период выраженной воспалительной реакции; 3) расходы энергии на постоянную (в
отсутствие инфекции) фагоцитарную и иммунную защиту легких сопоставимы по величине;
4) наименьшие расходы энергии связаны со специфическим
противобактериальным иммунным ответом, регенерацией легких и уменьшением отека, а также
метаболизмом бактерий.
Энергетический критерий эффективности противоинфекционной защиты.
Вычислим энергетическую цену ![]() противоинфекционной защиты "в целом'', с учетом
периодов болезни и здоровья. Зададим фиксированный отрезок
времени длины
противоинфекционной защиты "в целом'', с учетом
периодов болезни и здоровья. Зададим фиксированный отрезок
времени длины ![]() , на котором рассмотрим функционирование
противоинфекционной защиты. Пусть
, на котором рассмотрим функционирование
противоинфекционной защиты. Пусть ![]() , как и ранее, есть длительность одной
инфекции (
, как и ранее, есть длительность одной
инфекции (![]() ). Рассмотрим взаимодействие организма с одним видом
микроорганизмов с постоянными характеристиками. Предположим, что инфекции
повторные, а в момент очередного заражения, происходящего с постоянной
частотой
). Рассмотрим взаимодействие организма с одним видом
микроорганизмов с постоянными характеристиками. Предположим, что инфекции
повторные, а в момент очередного заражения, происходящего с постоянной
частотой ![]() , все величины параметров защитных систем (за исключением
параметра
, все величины параметров защитных систем (за исключением
параметра ![]() ) соответствуют исходным значениям. Пусть
) соответствуют исходным значениям. Пусть ![]() - вектор
параметров системы уравнений математической модели пневмонии. Предположим, что
- вектор
параметров системы уравнений математической модели пневмонии. Предположим, что
![]() не зависит от
не зависит от ![]() . Тогда величину
. Тогда величину ![]() можно представить в следующем виде:
можно представить в следующем виде:
Рассмотрим частный случай поставленной задачи, зафиксировав все компоненты вектора
![]() кроме уровня макрофагов в норме
кроме уровня макрофагов в норме ![]() (этот параметр выбран на основе
анализа чувствительности математической модели пневмонии). На рис. 2 показана динамика
концентрации микроорганизмов в легких, соответствующая оптимальным значениям
(этот параметр выбран на основе
анализа чувствительности математической модели пневмонии). На рис. 2 показана динамика
концентрации микроорганизмов в легких, соответствующая оптимальным значениям ![]() при различных
при различных ![]() . Видно, что при низких значениях
. Видно, что при низких значениях ![]() энергетически выгодным
оказывается
такое состояние системы противоинфекционной защиты, которое в случае заражения приводит к
острой форме бактериальной инфекции с выздоровлением; для высоких значений
энергетически выгодным
оказывается
такое состояние системы противоинфекционной защиты, которое в случае заражения приводит к
острой форме бактериальной инфекции с выздоровлением; для высоких значений
![]() оптимальное значение
оптимальное значение ![]() соответствует субклинической форме инфекции.
Частота
соответствует субклинической форме инфекции.
Частота ![]() =1,5
=1,5![]() 10
10![]() сут
сут![]() является пороговой, при которой
сосуществуют два решения задачи оптимизации, соответствующих острой и
субклинической форме болезни.
является пороговой, при которой
сосуществуют два решения задачи оптимизации, соответствующих острой и
субклинической форме болезни.
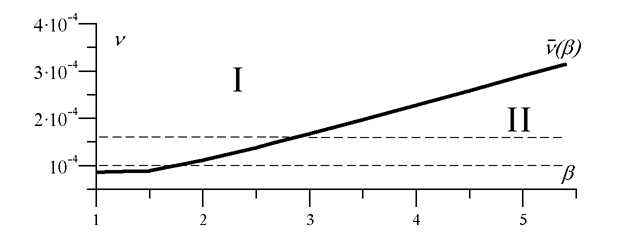 |
На рис. 3 изображена зависимость режимов оптимальной защиты организма ("идеальная
популяционная норма'') от параметров вирулентности ![]() и частоты инфицирования
и частоты инфицирования
![]() . По разные стороны от графика пороговой частоты инфицирования
. По разные стороны от графика пороговой частоты инфицирования
![]() (
(![]() ) типы оптимальных решений различны: область I соответствует
субклинической форме инфекции в ответ на заражение; II - острой форме болезни с
выздоровлением. Интервал между пунктирными линиями соответствует средней по популяции
частоте заболеваемости пневмонией.
) типы оптимальных решений различны: область I соответствует
субклинической форме инфекции в ответ на заражение; II - острой форме болезни с
выздоровлением. Интервал между пунктирными линиями соответствует средней по популяции
частоте заболеваемости пневмонией.
Интерпретация механизмов развития и методов лечения хронических бактериальных инфекций легких. Полученные результаты помогают объяснить формирование хронических бактериальных инфекций не только в результате нарушения механизмов защиты, но и как следствие адаптации и оптимизации этих механизмов. При высокой частоте инфицирования оптимальной с точки зрения энергетической цены защиты становится субклиническая форма инфекции, характеризуемая низкой концентрацией бактерий, которая, однако, длительно сохраняется в организме (рис. 2, 3). Такое состояние можно интерпретировать как формирование хронической, вяло текущей бактериальной инфекции. Следовательно, переход от острой инфекции с выздоровлением к хронической может рассматриваться как закономерный адаптационный сдвиг, закрепленный естественным отбором как способ экономии энергетических ресурсов. С этой точки зрения лечение хронической бактериальной инфекции должно обязательно включать меры по снижению частоты повторных заболеваний и обострений.
Известно, что наиболее частой причиной развития бактериальных инфекций легких являются вирусные инфекции, которые угнетают механизмы местного иммунитета и тем самым нарушают устойчивость состояния здоровья. Следовательно, во многих случаях первым этапом излечения хронической бактериальной инфекции должно являться излечение или защита от частых или хронических вирусных инфекций. Этот важный для теоретической и практической медицины вывод хорошо согласуется с базовыми положениями разработанного эмпирического метода лечения хронических бактериальных инфекций легких, примененного в клинических условиях на большой группе пациентов и принесшего по итогам многолетних наблюдений положительные результаты (Марчук, Бербенцова, 1989, 1995; Бербенцова, 2000).
Отметим, что на данном этапе исследований интерпретировать результаты вычислений
следует с осторожностью, это связано как минимум со следующими упрощениями в
постановке задачи: 1) организм адаптировался, варьируя только один, хотя и важный
параметр ![]() ; 2) рассматривалась адаптация только к одному патогену, хотя в природе
организм имеет дело с большим числом патогенов; 3) параметры патогена не менялись, но в
действительности они также подвержены естественному отбору. Применимость рассмотренного
подхода в более сложных моделях и постановках задач является предметом дальнейших
исследований.
; 2) рассматривалась адаптация только к одному патогену, хотя в природе
организм имеет дело с большим числом патогенов; 3) параметры патогена не менялись, но в
действительности они также подвержены естественному отбору. Применимость рассмотренного
подхода в более сложных моделях и постановках задач является предметом дальнейших
исследований.
Основные результаты и выводы. В работе построены и сопоставлены количественные оценки энергетической цены основных процессов противоинфекционной защиты организма при пневмонии. Показано, что энергетическая цена пневмонии определяется главным образом величиной снижения приспособленности, вызванного общими нарушениями баланса притоков и расходов энергии, и в меньшей степени расходами энергии на иммунную защиту. В отсутствие заболевания энергия расходуется на образование и поддержание функционирования клеток неспецифической (фагоцитарной) и специфической (лимфоциты и антитела) защиты. На основе энергетического критерия эффективности функционирования защитных систем организма удалось перейти от моделирования болезни к моделированию противоинфекционной защиты как при болезни, так и в ее отсутствие. С использованием указанного критерия сформулирована задача оценки параметров иммунной защиты организма. При этом предполагается, что искомые значения параметров можно интерпретировать как адаптированную норму состояния защитных систем к заданной частоте заражения.
Анализ результатов расчетов позволяет сделать следующие выводы: 1) энергетическая цена противоинфекционной защиты организма является биологически значимой характеристикой набора величин параметров модели и позволяет обосновать норму строения и функционирования системы противоинфекционной защиты при постоянных условиях внешней среды; 2) в зависимости от вирулентности микроорганизма и частоты инфицирования минимальный расход энергии на противоинфекционную защиту достигается при двух качественно различных динамических режимах инфекции: острой, клинически выраженной форме болезни, которая характерна для более вирулентных и редких инфекций и субклинической, более продолжительной и с незначительным повреждением организма форме болезни, характерной для менее вирулентных и частых инфекций; 3) введение общего принципа функционирования иммунной системы организма позволяет перейти от задач моделирования существенно переходных процессов в иммунной системе к более общим постановкам, рассматривающим состояние здоровья как сложный динамический процесс адаптации к факторам внешней среды.
 Ваши комментарии
Ваши комментарии
|
![[SBRAS]](/gif/s_sigma.gif)
[Головная страница] [Конференции] [СО РАН] |
© 2001, Сибирское отделение Российской академии наук, Новосибирск
© 2001, Объединенный институт информатики СО РАН, Новосибирск
© 2001, Институт вычислительных технологий СО РАН, Новосибирск
© 2001, Институт систем информатики СО РАН, Новосибирск
© 2001, Институт математики СО РАН, Новосибирск
© 2001, Институт цитологии и генетики СО РАН, Новосибирск
© 2001, Институт вычислительной математики и математической геофизики СО РАН, Новосибирск
© 2001, Новосибирский государственный университет
Дата последней модификации Wednesday, 26-Sep-2001 22:03:29 NOVST